Microbiota e Alimentazione
Microbiota intestinale e dieta chetogenica
La dieta chetogenica è un protocollo dietetico che è stato utilizzato dal 1920 come trattamento dell’epilessia farmaco-resistente e sta attualmente mostrando incoraggianti risultati sia in termini di perdita di peso che come potenziale terapia per le complicanze metaboliche dell’obesità, le malattie neurodegenerative, la sclerosi multipla ed altre condizioni croniche [cfr.1-2].

Prof.ssa Annamaria Colao
Presidente della Società Italiana di Endocrinologia - Professore Ordinario di Endocrinologia, presso l'Università di Napoli "Federico II".
In particolare la “Very Low Calorie Ketogenic Diet” (VLCKD) consiste in un intervento nutrizionale che mima il digiuno attraverso una drastica riduzione dell’apporto giornaliero di carboidrati, solitamente inferiore a 30 g/die con un proporzionale aumento della quota di grassi e proteine, raggiungendo un introito calorico giornaliero complessivo di solito <800 kcal [cfr.1-3]. La principale fonte energetica nel VLCKD non è rappresentata dal glucosio ma dai corpi chetonici (acetoacetato, betaidrossibutirrato e acetone). La chetogenesi si verifica a livello dei mitocondri degli epatociti, dove in condizione di ridotta disponibilità di glucosio l’acetil-CoA non potendo reagire con l’ossalacetato (preferenzialmente usato nella gluconeogenesi) entra nel ciclo degli acidi tricarbossilici e a seguito di una serie di reazioni enzimatiche viene convertito nei tre principali corpi chetonici [cfr.3].
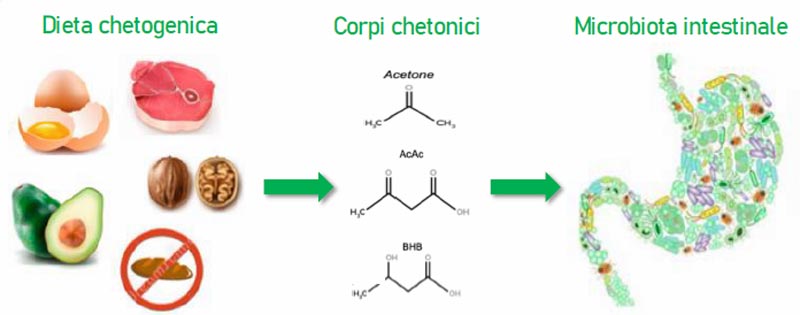
Dal momento che l’alimentazione rappresenta uno dei principali fattori che modificano il microbiota intestinale anche la dieta chetogenica sembra avere un impatto sulla composizione del microbiota (Figura 1), nonostante le evidenze siano piuttosto esigue e limitate all’uso di tale dieta a scopo terapeutico soprattutto in caso di epilessia refrattaria.
A questo proposito uno studio condotto su topi ha evidenziato come l’effetto anticonvulsivante indotto dalla dieta chetogenica possa essere parzialmente mediato dal microbiota intestinale [cfr.4]. È stato infatti osservato che dopo dieta chetogenica si verificava un aumento di Akkermansia e Parabacteroides con conseguente ridotta produzione dell’enzima γ-glutamil transferasi responsabile del trasferimento del gruppo gamma-glutamilico e formazione di amminoacidi γ-glutamilati [cfr.4]. La riduzione dei livelli di questi amminoacidi che hanno una differente permeabilità a livello della barriera ematoencefalica sembrerebbe determinare un aumento del rapporto GABA/glutammato nel cervello dei topi trattati, che potrebbe in parte spiegare le proprietà antiepilettiche della dieta chetogenica.
I due principali componenti di questa dieta sono rappresentati da grassi e proteine che possono modificare la composizione del microbiota intestinale.
La quota lipidica della VLCKD è rappresentata sia da grassi saturi che da grassi insaturi, mono e poli-insaturi. I primi sembrano avere un effetto negativo sulla composizione del microbiota determinando un aumento di Firmicutes e Proteobacteria e una riduzione di Bacteroidetes e Bifidobacterium spp che si traduce in un aumento della endotossine circolanti e in un effetto indiretto di aumento dell’insulino resistenza [cfr.5].
I grassi insaturi invece modulano i batteri intestinali aumentando la quota di Bifidobacterium, Lactobacillus e Akkermansia riducendo dunque l’infiammazione [cfr.6]. Pertanto la fonte di grassi e la loro qualità dovrebbe essere sempre considerata nella composizione di una dieta VLCKD al fine di preferire il consumo di grassi insaturi limitando la quota di quelli saturi.
In merito al consumo di proteine esse rappresentano la principale fonte di azoto per i microrganismi intestinali essenziale per la fermentazione dei carboidrati. Un’alimentazione ricca in proteine è stata associata ad aumento di Bacteroidetes e riduzione del peso ma con un aumentato rischio di aterosclerosi e malattie del colon soprattutto se associata ad uno scarso consumo di fibre [cfr.7]. Nell’animale da esperimento è stato infatti osservato che rispetto ad una dieta normoproteica una dieta iperproteica altera il microbiota del colon aumentando le spp Escherichia, Shigella, Enterococcus, Streptococcus e i batteri solfato riduttori [cfr.8]. Pertanto nell’ambito di una VLCKD sarebbe opportuno evitare regimi dietetici iperproteici.
In fine, considerando che la VLCKD non prevede l’uso di saccarosio, spesso esso viene sostituito con dolcificanti artificiali. Alcune evidenze scientifiche hanno dimostrato come il consumo di acesulfame o sucralosio alteri la composizione e la funzione del microbiota intestinale nonché l’integrità della parete intestinale rendendola maggiormente permeabile e favorendo l’infiammazione [cfr.9]. Pertanto, considerando che il consumo quotidiano di dolcificanti artificiali è stato associato a malattie cardiometaboliche, dovrebbe essere sconsigliato per il suo effetto controverso sulla salute globale e su quella del microbiota intestinale.
Figura 1: Impatto della dieta chetogenica sul microbiota intestinale.
La principale fonte energetica nella dieta chetogenica non è rappresentata dal glucosio ma dai corpi chetonici ( beta idrossibutirrato e acetone) i quali esercitano effetti a livello intestinale modificando la composizione del microbiota, nutrendo le cellule del colon e influenzando la motilità e l’assorbimento.
Riferimenti Bibliografici
- Muscogiuri G, Barrea L, Laudisio D, Pugliese G, Salzano C, Savastano S, Colao A. The management of very low-calorie ketogenic diet in obesity outpatient clinic: a practical guide. J Transl Med. 2019 Oct 29;17(1):356. doi: 10.1186/s12967-019-2104-z.
- Perez-Guisado J. Ketogenic diets: Additional benefits to the weight loss and unfounded secondary effects. Arch. Lat. Nutr. 2008;58:323–329.
- Caprio M. Very-low-calorie ketogenic diet (VLCKD) in the management of metabolic diseases: systematic review and consensus statement from the Italian Society of Endocrinology (SIE) Journal of Endocrinological Investigation 2019. 1365–1386.
- Olson C.A., Vuong H.E., Yano J.M., Liang Q.Y., Nusbaum D.J., Hsiao E.Y. The gut microbiota mediates the anti-seizure effects of the ketogenic diet. Cell. 2018;174:497.
- Wolters, M.; Ahrens, J.; Romani-Perez, M.; Watkins, C.; Sanz, Y.; Benitez-Paez, A.; Stanton, C.; Gunther, K. Dietary fat, the gut microbiota, and metabolic health—A systematic review conducted within the mynewgut project. Clin. Nutr. 2018
- Wan, Y.; Wang, F.; Yuan, J.; Li, J.; Jiang, D.; Zhang, J.; Li, H.; Wang, R.; Tang, J.; Huang, T.; et al. Effects of dietary fat on gut microbiota and faecal metabolites, and their relationship with cardiometabolic risk factors: A 6-month randomised controlled-feeding trial. Gut 2019, 68, 1417–1429.
- Nakatani, A.; Li, X.; Miyamoto, J.; Igarashi, M.; Watanabe, H.; Sutou, A.; Watanabe, K.; Motoyama, T.; Tachibana, N.; Kohno, M.; et al. Dietary mung bean protein reduces high-fat diet-induced weight gain by modulating host bile acid metabolism in a gut microbiota-dependent manner. Biochem. Biophys. Res. Commun. 2018, 501, 955–961
- Mu, C.; Yang, Y.; Luo, Z.; Guan, L.; Zhu, W. The colonic microbiome and epithelial transcriptome are altered in rats fed a high-protein diet compared with a normal-protein diet. J. Nutr. 2016, 146, 474–483.
- Nettleton, J.E.; Reimer, R.A.; Shearer, J. Reshaping the gut microbiota: Impact of low calorie sweeteners and the link to insulin resistance? Physiol. Behav. 2016, 164, 488–493