Donne e Microbiota
Estrogeni: come lavorano nel corpo della donna insieme al microbiota
Gli estrogeni sono gli ormoni femminili per eccellenza. Circolano nel sangue della donna in forme diverse:
- Libera (2%). Solo questa quota può esercitare le sue funzioni biologicamente attive, ossia gli effetti fisiologici.
- Legati a proteine del sangue come l’albumina (44%), che consente un legame più “lasso”, che consente di liberare rapidamente l’ormone estrogeno.
- Legati ad una proteina specifica che si chiama proteina legante gli ormoni sessuali o sex hormone-binding protein (SHBP) (50%), che lega l’estrogeno in maniera più stretta [cfr. 1] .

Prof.ssa Alessandra Graziottin
Presidente Fondazione Graziottin - Direttrice del Centro di Ginecologia e Sessuologia Medica dell’Ospedale San Raffaele Resnati di Milano.
Gli estrogeni sono molecole che hanno grande affinità per sostanze grasse (lipidiche). Grazie a questa caratteristica attraversano liberamente le membrane delle cellule. Possono così interagire con i recettori per gli estrogeni, come chiavi nella serratura, come prima anticipato.
Le serrature sono di due tipi: alfa e beta (Estrogen Receptor alpha (ERα) and Estrogen Receptor beta (ERβ)) (Fig. 1) [cfr. 2].
Le serrature o recettori, si trovano sia sulla superfice della cellula (membrana), sia nel nucleo. Quando l’estrogeno interagisce con il recettore nucleare, dà comandi precisi al nostro codice genetico (DNA) contenuto nel nucleo della cellula. Questi comandi presuppongono la trascrizione di alcuni geni nel nucleo, inducendo l’espressione di determinate proteine a valle. Questi avvenimenti avranno effetti diversi a seconda del tessuto in cui avvengono [cfr. 2 – 3].
Come vengono eliminati gli estrogeni?
Gli ormoni estrogeni sono preziosi per l’organismo purché a livelli adeguati a quella specifica fase di vita della donna. Il loro ciclo vitale prevede: produzione, utilizzo (metabolismo), eliminazione attraverso fegato-bile-intestino e/o reni-vescica-urine [cfr. 4].
Siccome tutti gli organismi viventi tendono ad essere “economici”, tendono anche a risparmiare ormoni, se possibile, riassorbendoli dall’intestino.
Proprio a questo obiettivo è finalizzato il microbiota con la sua componente di estroboloma.
Infatti, come tutte le molecole che circolano nel sangue, anche i diversi tipi di estrogeni raggiungono il fegato dove vengono coniugati con l’acido glucuronico.
Questa reazione chimica ha due scopi:
- Inattivarli, in modo che non siano più bioattivi, e quindi non possano esercitare i loro effetti sul corpo;
- Aumentare la loro solubilità plasmatica, così che sia favorita la loro eliminazione. Infatti, come anticipato, gli estrogeni coniugati sono escreti nella bile, nelle urine e nelle feci.
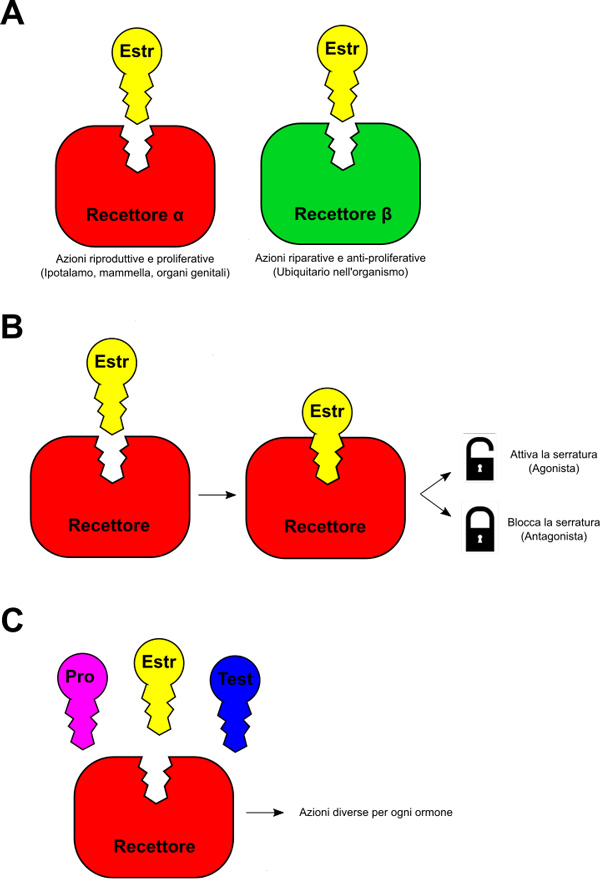
Figura 1. Rappresentazione dell’interazione tra ormoni e recettori per gli estrogeni.
A) Serrature diverse, anche quando “aperte dalla stessa chiave ormonale”, possono mediare azioni diverse: l’ERα, situato soprattutto in ipotalamo, mammella e organi genitali, media azioni riproduttive e proliferative.
Il ERβ, ubiquitario nei tessuti dell’organismo, media le azioni riparative e antiproliferative.
B) Un ormone può “aprire la serratura” e quindi attivare il proprio recettore (agonista), o “bloccare la serratura” e quindi inibire l’azione del recettore (antagonista).
C) Ormoni diversi (e.g. estradiolo, testosterone e progesterone) possono interagire con i recettori mediando interazioni diverse. Questa sinfonia ormonale che presenta note diverse e ritmi diversi vale anche per il microbiota.
La complessità della regia ormonale della nostra salute che possiamo immaginare come una partitura musicale, con strumenti diversi, note diverse e ritmi diversi, agisce non solo sulle cellule del nostro corpo. Agisce in una maniera molto articolata anche sul microbiota.
Il microbiota a sua volta è un interlocutore attivo in particolare nel metabolismo di alcuni ormoni.
Si tratta di un campo di ricerca in fase di crescita vertiginosa per cui anche le nostre conoscenze cambiano rapidamente perché ci stiamo affacciando ad una complessità fino a pochi anni fa impensata tra:
- ormoni sessuali,
- microbiota
- salute della donna.
Per esempio, ecco perché una donna può presentare perdite di sangue (spotting) quando assume un contraccettivo orale, pur assumendolo regolarmente.
Se c’è una disbiosi, un’alterazione del microbiota, gli ormoni che controllano questo processo sono utilizzati in modo diverso.
Oppure, la perdita/spotting può essere dovuta ad una diarrea da disbiosi, che accelera il transito intestinale.
Come l’estroboloma regola gli estrogeni
Come abbiamo visto nella sezione precedente, la quantità di estrogeni non dipende solo da fattori endogeni, come la sintesi da parte delle ovaie o il tasso di smaltimento epatico, ma sono ulteriormente regolati dall’attività dell’estroboloma, che può influenzarne l’emivita in circolo [cfr. 5].
Gli estrogeni coniugati escreti nell’intestino incontrano i batteri del microbiota intestinale. Il loro estroboloma codifica per degli enzimi detti β-glucuronidasi (indicati con la sigla GUS), che invertono questo processo deconiugando gli estrogeni dall’acido glucuronico, ossia liberandoli dal legame, e ripristinando la loro forma libera e bioattiva.
Questi estrogeni deconiugati vengono riassorbiti e ritornano dunque nel sangue. Sono perciò in grado di diffondersi all’interno delle cellule dei tessuti di tutto il corpo.
Dentro di queste gli estrogeni interagiranno con i loro recettori nucleari alpha/beta estrogen receptor ERα e ERβ, causando degli eventi fisiologici a valle di varia natura [cfr. 6 – 7 -8 – 9].
Pensiamo quindi all’enorme influenza che il microbiota può esercitare sulla donna solo modulando i livelli di estrogeni: peso, libido, stato d’animo, stati infiammatori, sono solo alcuni degli aspetti coinvolti!
La disbiosi
La disbiosi è un’alterazione della composizione della popolazione batterica intestinale. La disbiosi, causata per esempio da terapie antibiotiche che bersagliano alcune classi di batteri rispetto ad altri, può avere conseguenze anche sull’attività dell’estroboloma, influenzando la quantità di estrogeni in circolo.
Nel caso che i batteri esprimenti GUS aumentassero rispetto a quelli che non la esprimono, la deconiugazione dall’acido glucuronico dall’estrogeno aumenterebbe, alzando di conseguenza i livelli plasmatici di estrogeni liberi nel sangue.
Poiché gli estrogeni sono ormoni che promuovono la proliferazione cellulare, un alto livello plasmatico potrebbe correlare con un maggior rischio di sviluppare patologie proliferative come tumori ormono-sensibili, fibromi uterini ed endometriosi, cioè l’iperproliferazione benigna di cellule endometriali in sedi extra-uterine, oltre che all’interno del muscolo che costituisce la parete uterina [cfr. 10 – 11].
Si parla in tal caso di “adenomiosi”. Alcuni studi mostrano come le pazienti che hanno sviluppato tumori estrogeno-sensibili come quello della mammella, dell’endometrio e dell’ovaio, presentino livelli di estrogeni plasmatici più alti della media. In tal caso questo tipo di scenario disbiotico potrebbe contribuire a spiegare la predisposizione di alcune donne per queste patologie [cfr. 5 – 12 – 13].
Nello scenario disbiotico opposto, se i batteri producenti GUS diminuissero, gli estrogeni rimarrebbero più glucuronidati e sarebbero eliminati dall’organismo più facilmente, con conseguente calo dei loro livelli plasmatici. Quando gli estrogeni sono carenti, la donna presenta una maggiore vulnerabilità per patologie simili a quelle osservate nella fase post-menopausale, quando la concentrazione di estrogeni cala a causa del decadimento della funzionalità ovarica.
Sindrome metabolica (diabete, obesità e malattie cardiovascolari), osteoporosi, deterioramento delle cartilagini, della pelle oltre a sintomi del tratto riproduttivo sono tutte conseguenze associate ad una carenza di estrogeni.
Crescenti evidenze scientifiche dimostrano come la modulazione esterna del microbiota intestinale tramite interventi quali modificazioni della dieta, assunzione di prebiotici (sostanze che supportano la crescita di determinati ceppi batterici), probiotici (ceppi batterici), trapianto di microbioma fecale (fecal microbiome transplant – FMT) e chirurgia bariatrica abbiano un effetto anche sull’andamento delle patologie sopra descritte.
Microbiota e vulnerabilità ai farmaci
Prof. Alessandra Graziottin
Riferimenti Bibliografici
- Hammond GL (2016) Plasma steroid-binding proteins: Primary gatekeepers of steroid hormone action. J Endocrinol 230:R13–R25. https://doi.org/10.1530/JOE-16-0070
- Hamilton KJ, Hewitt SC, Arao Y, Korach KS (2017) Estrogen Hormone Biology, 1st ed. Elsevier Inc.
- Fuentes N, Silveyra P (2019) Estrogen receptor signaling mechanisms, 1st ed. Elsevier Inc.
- Tsuchiya Y, Nakajima M, Yokoi T (2005) Cytochrome P450-mediated metabolism of estrogens and its regulation in human. Cancer Lett 227:115–124. https://doi.org/10.1016/j.canlet.2004.10.007
- Parida S, Sharma D (2019) The Microbiome-Estrogen Connection and Breast Cancer Risk. Cells 8:. https://doi.org/10.3390/CELLS8121642
- Ervin SM, Li H, Lim L, et al (2019) Gut microbial β-glucuronidases reactivate estrogens as components of the estrobolome that reactivate estrogens. J Biol Chem 294:18586–18599. https://doi.org/10.1074/jbc.RA119.010950
- Dabek M, McCrae SI, Stevens VJ, et al (2008) Distribution of β-glucosidase and β-glucuronidase activity and of β-glucuronidase gene gus in human colonic bacteria. FEMS Microbiol Ecol 66:487–495. https://doi.org/10.1111/j.1574-6941.2008.00520.x
- Baker JM, Al-Nakkash L, Herbst-Kralovetz MM (2017) Estrogen–gut microbiome axis: Physiological and clinical implications. Maturitas 103:45–53. https://doi.org/10.1016/J.MATURITAS.2017.06.025
- Kwa M, Plottel CS, Blaser MJ, Adams S (2016) The intestinal microbiome and estrogen receptor-positive female breast cancer. J Natl Cancer Inst 108:. https://doi.org/10.1093/JNCI/DJW029
- García-Peñarrubia P, Ruiz-Alcaraz AJ, Martínez-Esparza M, et al (2020) Hypothetical roadmap towards endometriosis: Prenatal endocrine-disrupting chemical pollutant exposure, anogenital distance, gut-genital microbiota and subclinical infections. Hum Reprod Update 26:214–246. https://doi.org/10.1093/HUMUPD/DMZ044
- Jiang I, Yong PJ, Allaire C, Bedaiwy MA (2021) Intricate connections between the microbiota and endometriosis. Int J Mol Sci 22:1–23. https://doi.org/10.3390/ijms22115644
- Plottel CS, Blaser MJ (2011) Microbiome and malignancy. Cell Host Microbe 10:324–335. https://doi.org/10.1016/j.chom.2011.10.003
- Bodai BI, Nakata TE (2020) Breast Cancer: Lifestyle, the Human Gut Microbiota/Microbiome, and Survivorship. Perm J 24:. https://doi.org/10.7812/TPP/19.129